摘要
ICU中抗生素的巨大消耗导致了巨大的体内微生态破坏,促进了耐多药细菌(MDRB)在环境中的传播。更有甚者,在接受经验抗生素治疗的ICU患者中,多达一半的患者没有明确的诊断感染,而在有文献记载的脓毒症患者中,对降阶梯治疗和缩短抗生素使用时间均考虑不足,这突出了实施抗生素管理项目(ASP)和其他质量改进举措的潜在益处。本文的目的是总结ICU抗生素治疗优化的现有证据、新出现的选择和尚未解决的争议。已有的研究尤其支持:需更好的识别患者MDRB感染的危险,更精确的诊断工具用以诊断和排除细菌性脓毒症,选择单药或联合用药的方案的个体化理由,足够的剂量和给药方案,以确保实现药物动力学/药效学目标,同时实时做好感染源控制,对初始治疗的系统再评估,从而通过降阶梯和缩短抗生素使用时间最小化对共存的微生态系统的附带损害。
关键词:抗生素管理,抗菌素耐药,经验性治疗,危重症,碳青霉烯类,预后,脓毒症
前言
抗生素在世界范围内ICU中广泛应用。虽然早期充分实施经验性抗菌素覆盖对于治愈社区和医院获得性脓毒症患者至关重要,但抗菌治疗并不总是有针对性的,在超过两例患者之外就可能存在一例没有明确感染的抗生素使用。此外,抗生素的降阶梯考虑还不够充分。由此产生的选择压力以及对多重耐药细菌(MDRB)交叉定植的无法完全控制,使ICU成为医院内耐药病原体传播的重要决定因素。作为抗菌药物管理项目(ASP)的重要参与者,重症医师应在严重感染和脓毒症治疗方案的制定、优化和推进方面处于领先地位,包括限制抗生素的过度使用。
这个基于文献检索(MEDLINE数据库)叙事性综述完成于2018年9月,我们试图总结ICU抗生素治疗优化最新进展和新观点,特别是更好地识别有MDRB感染风险的患者,更精确的诊断/排除细菌性脓毒症的诊断工具,选择单药或联合用药的方案的个体化理由,使用适当的剂量和给药方案,以确保达到药物PK/PD的目标,同时实时做好感染源控制,对初始治疗的系统的再评估,从而通过降阶梯和缩短抗生素使用时间最小化对共存的生态系统的附带损害。
我们还旨在为在ICU中制定可操作ASP收集论据,包括改善患者预后和减少与抗生素相关的选择压力,这可能有助于控制MDRB在医疗机构中的传播。
抗生素治疗如何导致耐药
产超广谱-β-内酰胺酶肠杆菌科(ESBLE)和MDR铜绿假单胞菌感染负担稳步上升,耐碳青霉烯不动杆菌和耐碳青霉烯酶产肠杆菌科(CRE)在全球范围内蔓延,耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素肠球菌成为多个地域的重大问题。这些趋势现在既适用于ICU获得性感染,也适用于MDRB在医院病房和其他医疗环境中的成功传播带来的输入性细菌败血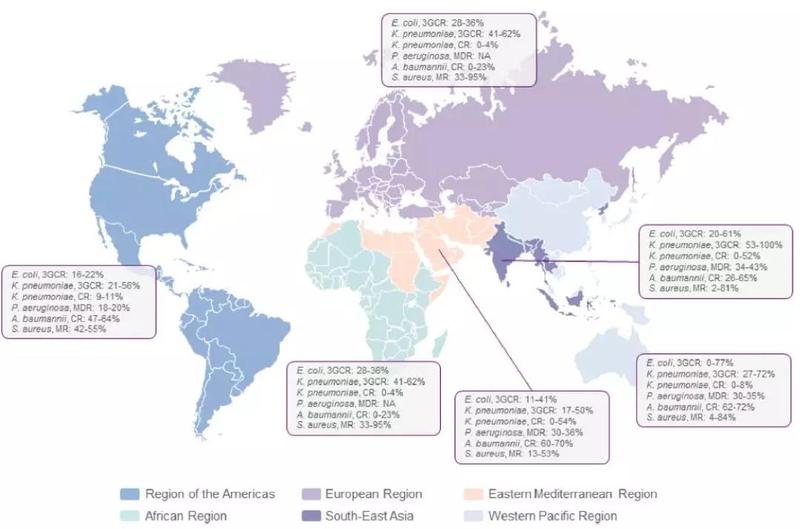
图1根据世界卫生组织(世卫组织)各区域报告,目前院内获得性感染的主要病原体的耐药性。3GCR:第三代头孢菌素耐药,CR:碳青霉烯耐药,MDR:多重耐药,MR:耐甲氧西林。数据提取于2014年WHO抗菌素耐药全球报告,2011-2014年国家医疗安全网络/疾病控制和预防中心报告,2016年欧洲抗菌素耐药性监测网络年度报告,2010-2015年国际医院感染控制的联合报告,2014年CHINET监测网络报告,和其他参考文献。在ICU获得性感染的特定情况下,获得的耐药率数据在所有地理区域均在较高范围。
多达70%的ICU患者在某一天接受经验或明确的抗菌治疗。据最近估计,ICU人群的抗生素平均消耗量为每1000名患者日确定剂量(DDD值)为1563(95%置信区间1472-1653),几乎是普通病房患者的三倍,其中广谱制剂应用,如第三代头孢菌素,存在着显著差异。尽管大多数情况下,抗生素耐药的潜在机制来自于并非直接由抗生素诱导的随机的基因事件,但这些药物所施加的选择压力是细菌耐药性的一个强有力的驱动因素(图2)。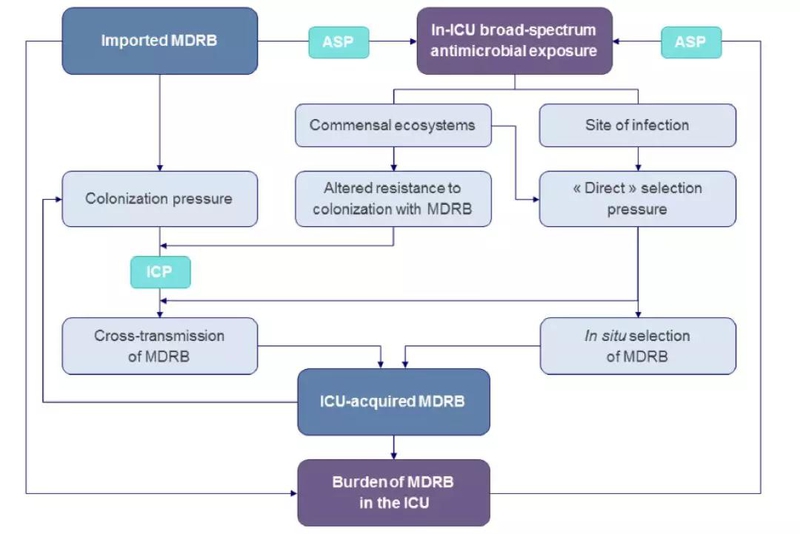
图2 ICU中抗菌素耐药性的驱动因素。MDRB:多重耐药细菌,ASP:抗菌药物管理项目,ICP:感染控制项目。“直接”选择压力表明:病原菌对所给药物具有选择性耐药。绿色小插图:对策的定位。ASP:可以完全包含旨在限制抗菌剂对生态影响的每一项干预措施,包括合理的经验启动、选择活性谱最窄(尤其是针对常住肠道厌氧菌)和肠道生物利用度最低的适当药物以及缩短治疗时间。ICP可能包括教育干预,以确保高度遵守手部卫生和其他标准预防措施,在MDRB携带者(如碳青霉烯基肠杆菌科)中采取有针对性的接触预防措施,适当处理排泄物,以及环境消毒。
在患者层面,抗菌素暴露可使具有固有耐药或获得耐药病原体过度生长,获得性耐药在某种程度源自在感染部位的共生微生态系统的药物使用。值得注意的是,一些机制可能导致对各种类型的耐药性,特别是在非发酵革兰氏阴性菌中外排泵的过表达,从而导致仅在单药暴露后出现MDR变异。在ICU,一个特定抗生素的消耗量与临床分离株的耐药率相关,(包括碳青霉烯类或多粘菌素),尽管这可能随细菌种类和环境的不同而变化。
然而,除了其临床抗菌谱外,在评价每种抗生素的生态影响时还应考虑其抗厌氧特性。事实上,通过原位选择、交叉传播或环境宿主获得的MDR革兰氏阴性菌可能会因为正常肠道微生态(主要是常住菌)的抗菌素相关改变及其带来的定植耐药性而减轻。抗厌氧菌药物使用之前可能明显倾向于与ESBL-E、产AmpC的肠杆菌科或CRE定植。抗厌氧菌药物的胆汁排泄程度是评价其对肠道的潜在影响的另一个关键因素。
多重耐药菌的风险因素
确定MDRB感染的风险因素的临床价值是在获得培养结果之前指导经验治疗,即:病原体识别和耐药性检测(AST)。然而,由于宿主、环境和病原体之间的复杂相互作用,没有单一的算法来用于预测MDRB感染,因此需要采用个体化的概率方法来选择经验药物(表1)。
MDRB定植显著增加了随后MDRB感染的风险。然而,无论定植菌是什么,这个风险因子的阳性预测值都不会超过50%。例如,只有10-25%的ESBL-E携带者在ICU期间发生ESBL-E感染。MDRB携带者是否被感染与其他一系列因素有关,这些因素可能与获得性定植风险相关也可能不相关。总之,是否有文献记载不应被认为是选择经验疗法的唯一必要条件。
合并多种晚期疾病、住院时间过长、侵入性操作使用以及之前抗生素暴露的患者患MDRB感染的风险增加。患者的地域是另一个决定风险的因素,因为全球、区域、甚至同一城市的医院内的MDRB流行病学存在巨大差异。造成这些差异的原因可能包括社会经济因素以及病例组合、抗菌药物消耗和卫生习惯的差异。
图文来源:微信公众号 遵医重症
图文编辑:唐彪
图文审核:李明泉 徐勇











